
今天我们想带大家一起来回顾一下AP化学考点微观粒子,这部分AP化学考试内容常常都会以不同的形式出现,如果同学们正复习化学,不妨花几分钟的时间一起来看看这部分的考点。
分子形状
同学们知道分子非常非常的小,分子也有自己的形状。AP化学考试中会涉及13种分子形状的考察(部分分子形状如图)。

对于判断分子形状我们有两种方法,种就是首先画出路易斯结构图,判断出中心原子周围成键电子域和未成键电子域数目,从而确定分子形状。第二方法写出分子的AXE构型,从而判断分子形状。 A-中心原子, X-边原子, E-中心原子未成键电子域的数目。
例如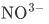 的中心原是N ,边原子O的数目是3;关于中心原子N 周围未成键电子域的数目我们可以用化合价法来判断。N的化合价为+5意味着N有5个电子参与成键,N最外层只有5个电子,所以5个电子全都参与成键,N周围并没有未成键电子域,那么
的中心原是N ,边原子O的数目是3;关于中心原子N 周围未成键电子域的数目我们可以用化合价法来判断。N的化合价为+5意味着N有5个电子参与成键,N最外层只有5个电子,所以5个电子全都参与成键,N周围并没有未成键电子域,那么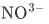 的AXE构型为AX3。如果我们能判断出构型为AX3,那么分子形状就是平面三角形。
的AXE构型为AX3。如果我们能判断出构型为AX3,那么分子形状就是平面三角形。
分子熔沸点
物质宏观的性质主要取决于微观粒子,那么宏观上分子熔沸点高低取决于分子间作用力大小。因为分子发生相变需要克服分子间作用力,分子间作用力越大,分子的熔沸点就越高。所以题目考察分子的熔沸点,就是考察分子间作用力大小的比较。关于分子间作用力AP化学最为主要会考察到伦敦色散力,偶极-偶极作用力,氢键。一般情况下,氢键是分子间作用力里面最强的,所以如果能分析出分子间能够形成氢键,分子的熔沸点会相对来说异常偏高一些。
我们可以分析一道有关分子间作用力的考题。
溶解度
当我们把乙醇倒入水中,发现乙醇会完全溶于水;当我们把油滴入水中,发现油滴浮在水面,油难溶于水。关于宏观上的物质的溶解度大小同样我们需要从微观粒子层面来分析。
同学们可能都听过“相似相溶”原理,什么是“相似相溶”呢?就是极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。水和乙醇都是极性分子,而且水和乙醇分子间可以形成氢键,水和乙醇分子间很产生很强的吸引力,因此水和乙醇互溶。油滴属于非极性分子,而水是极性分子,水和油滴间的吸引力比较小,因此油滴难溶于水。
专业名词
molecular shape 分子形状
trigonal planar三角平面
bonding electron domain成键电子域
nonbonding electron domain未成键电子域
central atom中心原子
end atom边原子
polar molecule极性分子
nonpolar molecule非极性分子
London dispersion force伦敦色散力
dipole-dipole force偶极-偶极作用力
H bonding氢键
solubility溶解度
以上就是AP化学微观粒子的知识点了,同学们要注意在,AP化学倾向于考查同学们对原理的理解,所以同学们要有从微观粒子层面的知识去解释物质的宏观性质的能力。
不管是英国前10还是美国前20的学校,都非常认可及重视AP成绩。而且一般来说只有4-5分的才能换到比较好的大学的学分,也就是说一旦参加考试,4分以上的分数才对申请有意义。如果这对你来说很难,甚至连自我感觉连保3都很有压力,点击预约试听【AP同步培训班】,紧贴考纲,精编唯寻核心讲义,AP将带你在AP灵活的考察体系里快速上分。

AP化学信息,点击
可查看更多。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
