
阿伏加德罗常数是一个非常重要的ALEVEL化学考试考点,本文就来给大家详细整理下该考带点的相关概念与常见考法。
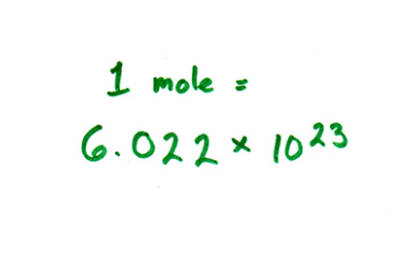
学习ALevel化学需要了解有机化学、无机化学中所包含的知识点,一些化学方程式、源自结构、化学键等内容都会有涉及。
但国际学校时的化学是更偏向于理论,靠记忆得分,实验的部分就比较少,而大学时要学的化学,偏向于理解原理,更看重实验操作。因此想在国际学校阶段拿化学A*也没有那么难。
a level化学考试分为AS和A2阶段,总共有5张考卷。Paper1、2、3是AS阶段,必须同时报考三张试卷;Paper4、5是A2阶段,必须同时报考两张试卷。
每份考卷按照题型分类,并且每份考卷的占比不同
考点一:阿伏加德罗常数
阿佛加德罗常数(用NA表示)涉及的知识面广,灵活性强,是热点之一,主要以选择题的形式(选择正确的或错误的)进行考查。分析近几年的ALEVEL化学考试试题,此类题型常以选择题形式出现,容易引起学员错误的有以下几点:
1、温度和压强:22.4L/mol是在标准状况(0℃,1.01×105Pa)下的气体摩尔体积。命题者有意在题目中设置非标准状况下的气体体积,让考生与22.4L/mol进行转换,从而误入陷阱。
2、物质状态:22.4L/mol使用的对象是气体(包括混合气体)。命题者常把一些容易忽视的液态或固态物质作为气体来命题,让考生落入陷阱。如SO3:常温下是固态;水:常温下是液态。戊烷,辛烷常温下是液态等。
3、物质变化:一些物质间的变化具有一定的隐蔽性,有时需要借助方程式分析才能挖掘出隐含的变化情况。考生若不注意挖掘隐含变化往往会误入陷阱。如NO2:存在与N2O4的平衡。
4、单质组成:气体单质的组成除常见的双原子分子外,还有单原子分子(如稀有气体Ne:单原子分子)、三原子分子(如O3)、四原子分子(如P4)等。考生如不注意这点,极容易误入陷阱。
5、粒子数目:粒子种类一般有分子、原子、离子、质子、中子、电子等。1mol微粒的数目即为阿佛加德罗常数,由此可计算分子、原子、离子、质子、中子、电子等微粒的数目。命题者往往通过NA与粒子数目的转换,巧设陷阱。
1、阿伏加德罗定律:
在同温同压下,同体积的气体含有相同的分子数。
2、阿伏加德罗定律的推论:原理:同T、P下,V1/V2=N1/N2=n1/n2①n=N/NA=m/M=V/Vm②气体状态方程PV=nRT③
(1)三正比:
同温同压下,气体的体积比等于它们的物质的量之比V1/V2=n1/n2
同温同体积下,气体的压强比等于它们的物质的量之比p1/p2=n1/n2
同温同压下,气体的密度比等于它们的相对分子质量之比M1/M2=ρ1/ρ2
(2)二反比:
同温同压下,相同质量的任何气体的体积与它们的相对分子质量成反比V1/V2=M2/M1
同温同体积时,相同质量的任何气体的压强与它们的摩尔质量的反比ρ1/ρ2=M2/M1。
(3)一连比:
同温同压下,同体积的任何气体的质量比等于它们的相对分子质量之比,也等于它们的密度之比。
m1/m2=M1/M2=ρ1/ρ2(注:以上用到的符号:ρ为密度,p为压强,n为物质的量,M为摩尔质量,m为质量,V为体积,T为温度;上述定律及其推论仅适用于气体,不适用于固体或液体。)
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)的漏洞补齐。
希望以上内容能帮到你的ALEVEL化学考试。5月大考迫在眉睫,CIE家的学员就抓紧复习吧。别家考试局的同学也不能松懈,毕竟预估分也没有想得那么简单。哪怕是在去年预估分虚高的情况下,还是有不少学员因为分数过低错过的。何况还有外部卷、模拟考、秋季大考在前方待机。
如果想知道考前自己还有哪些方面需要提升,可以点击预约试听【唯寻ALEVEL复习冲刺班】——
知名大学海归ALEVEL导师授课
根据学校进度与学员个人情况定制课程
多轮筛选考纲
精准狙击必考知识点
高效处理复习弱点
系统规划学习和刷题时间
无论打分规则怎样变化都锁定A*
唯寻学员。
。
更多ALEVEL学习攻略点击
ALEVEL数学考试有哪些重要得分点?这些解题步骤让你更靠近A*

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
