
AP化学中的气体定律常常是以计算题的形式出现,那么本期就来给大家详细的讲讲AP化学气体3大气体定律的一些知识点,有复习需求的同学赶紧来看看吧!
道尔顿分压定律
道尔顿分压定律(也称道尔顿定律)描述的是理想气体的特性。这一经验定律是在1801年由约翰·道尔顿所观察得到的。其描述如下:
在组分之间不发生化学反应的前提下,理想气体混合物的总压力等于各组分的分压力之和。
P=P1+P2+……+Pn
需要注意的是,实际气体并不严格遵从道尔顿分压定律,在高压情况下尤其如此。当压力很高时,分子所占的体积和分子之间的空隙具有可比性;同时,更短的分子间距离使得分子间作用力增强,从而会改变各组分的分压力。这两点在道尔顿定律中并没有体现。
阿码加分体积定律
(1)阿玛格分体积定律:低压气体混合物的总体积等于组成该气体混合物的各组分的分体积之和。
(2)分体积:所谓分体积就是指气体混合物中的任一组分B单独存在于气体混合物所处的温度、压力条件下所占有的体积VB。
p,T一定时
pV.=nRTpV-nRT
V总= VA+ VB
在恒温恒压下,某组分的分体积等于该组分产生与混合气体相同的压力时所占据的体积。
格拉罕姆气体扩散定律
英国物理学家格拉罕姆(Graham)提出:同温同压下气体的扩散速率u与其密度ρ的平方 根成反比。
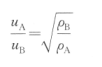
这就是气体扩散定律
由
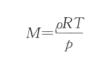
得
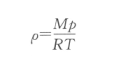
将其代入气体扩散定律公式,得
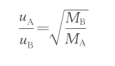
即同温同压下气体的扩散速率与摩尔质量的平方根成反比。
气体的液化
一般采用降温或加压的方法使气体液化。实验结果表明,当气体温度高于某一值时无论施加多大压力都不能使其液化。
通过加压能使某气体液化的最高温度称为该气体的临界温度,用Tc表示;达到临界温度时使气体液化所需要施加的最低压力称为该气体的临界压力,用pc表示;在临界温度和临界压力下1mol气体所占有的体积称为该气体的临界体积,用Vc表示。气体同时处在临界温度和临界压力时的状态称为临界状态。
临界状态是物质的一种特殊存在形式,此时气、液同性,状态不分,往往具有非常规的性质。人们利用临界状态的特殊性质,合成一些在通常情况下难以合成的物质,提取、分离一些在通常情况下难以提取的物质。
AP化学考试理想分的容错率为25%左右(随难度变化上下浮动),就容错率与题目难度的对应来看,理想分已经相对很好拿了。所以考这门课的同学更要以理想分为目标哦。如果你还没有找到复习方法,点击预约试听【唯寻AP复习冲刺班】——

点击
查看。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
