
在AP化学考试中平衡状态是经常考到的考点,提到平衡状态就离不开可逆反应,下面就一起来看看唯寻给大家收集的一些AP化学可逆反应知识点吧!

AP化学可逆反应知识点
可逆反应定义
在同一条件下。既可以向正反应方向进行,同时又可以向通反应方向进行的化学反应。
特点
相同条件下:
正、逆反应同时进行。
②一小:反应物与生成物同时存在:任一组分的转化率都小于。
化学平衡:一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的质量或浓度保持不变的状态。
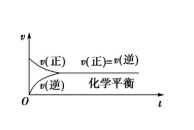
平衡特点
化学平衡是一种动态平衡
正反应速率=逆反应速率
反应物和生成物的质量或浓度保持不变
条件改变,平衡状态可能改变新条件下建立新的平衡状态
判化学平衡状态的两种方法
动态标志:v正=V逆
同种物质:同一物质的生成速率等于消耗速率。
不同物质:必须标明是“异向”的反应速率关系。
静态标志:各种“量”不变
①各物质的质量、物质的量或浓度不变。
②各物质的百分含量(物质的量分数、质量分数等)不变。
③温度、压强(化学反应方程式两边气体体积不相等)或颜色(某组分有颜色)不变。
总之,若物理量由变量变成了不变量。则表明该可逆反应达到平衡状态;若物理量为“不变量”,则不能作为平衡标志。
对于大部分同学来说,AP化学考试的答题节奏还是非常紧张的。如果这个问题也困扰着你,可以点击预约试听【AP化学衔接冲刺班】,相信只要肯学都是路——
点击
AP化学分子和离子化合物性质分享 这些易错点你还没GET到吗
查看。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
