
很多学员在学习IGCSE化学时总感到很吃力,因为他们没有正确结构IGCSE化学的知识点,其次也没了解过IGCSE化学每个知识点部分应该用什么方法来学习,下面就给大家讲讲常考的IGCSE化学Bonding and structure,学IGCSE化学的同学千万不要错过。
空气中主要成分中含有氩、氖、氦、氪、氙等稀有气体,这些稀有气体是以单原子形式存在的。原因就在于核外电子排布显示它们已经达到了fullshell的稳定结构,因此稀有气体原子较难与其他元素结合。
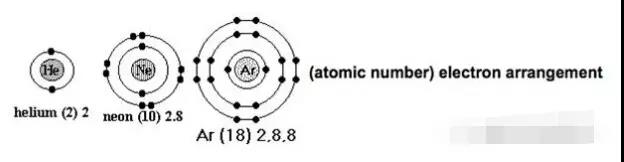
而其他原子本身不稳定,只能通过与其他原子相互结合,形成像noblegases 一样的相对稳定的fullshell结构。这种结合可以发生在原子之间,也可以存在于离子之间,我们把这种原子或离子间强烈的相互作用称之为chemical bonding。
Bonding type
Chemical bonding共有三种基本类型-ionic bond, covalent bond 及metallicbond。
Ionic bond:Non-metals + Metals
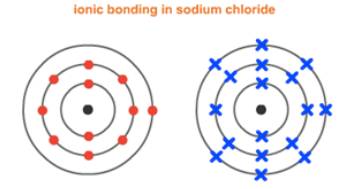
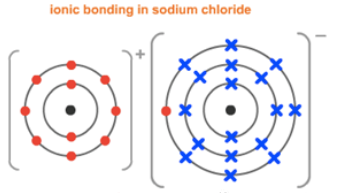
以NaCl为例,Na原子有1个valence electron, 为达到fullshell稳定结构,会失去一个电子,形成Na+。Cl原子有7个valence electron,需要得到一个电子,形成Cl-,才能达到full shell稳定结构。Na+和Cl-之间相互吸引,二者之间存在的强烈的静电力作用即为ionic bond。
Covalentbond:Non-metals + Non-metals
Covalent bond是原子间通过共用电子所形成的相互作用。以HCl的形成为例,在共用1对电子对之后,H和Cl原子都达到了fullshell的稳定结构。

Metallicbond:Metals
Metallic bond存在于金属中。通常情况下,金属原子的部分或全部外围电子受原子核的束缚比较弱,在金属晶体内部,它们可以从金属原子上“脱落”下来,形成自由移动的电子。这些电子不专属于某个特定的金属离子,是均匀分布于整个晶体中。金属离子与自由电子之间强烈相互作用,从而形成某种结合,这种作用称为金属键。

Structure
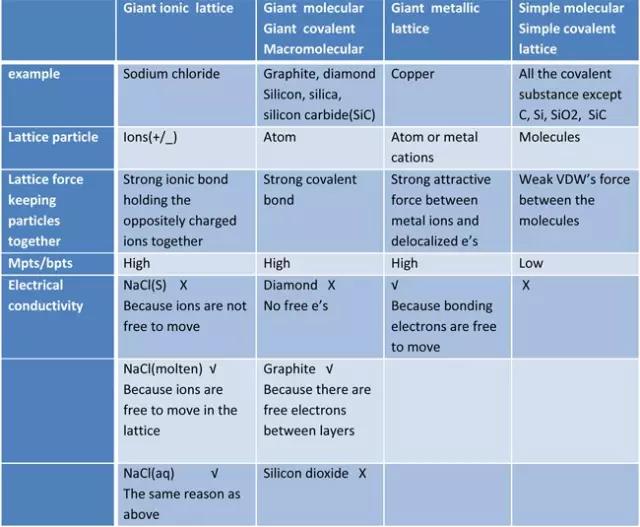
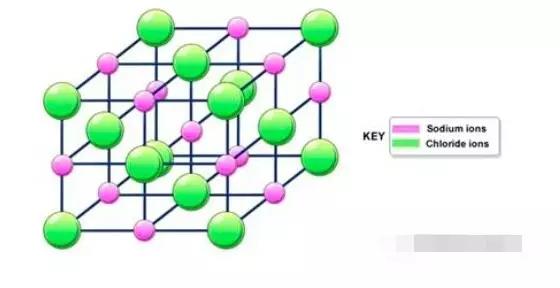
Ionic bond –Giant ionic lattice
Giant ionic lattice是由阴离子和阳离子通过ionicbond结合而成的晶体。从NaCl结构示意图可以看出,Na+和Cl-在晶体中按照一定的规则有序排列。
Covalent bond – Simple molecules and Giant covalentstructure
Giantcovalent structure里,所有原子都以covalentbond相互结合,形成三维的网状结构。常见的giantcovalent structure有diamond,graphite,silicondioxide。
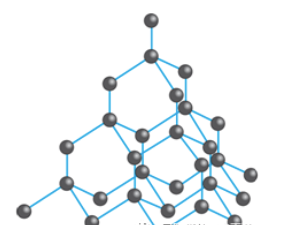
Dimond
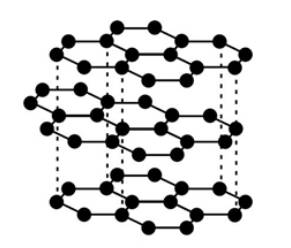
Graphite
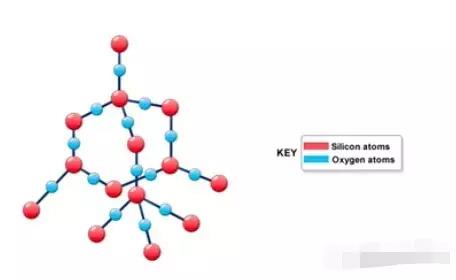
像H2, Cl2,H2O, CH4, HCl等simplemolecules中原子间以covalentbond结合,分子间以范德华力相互结合。

Metallic bond – Giant metalliclattice
在金属单质的晶体中,原子之间以metallicbond相互结合,自由移动的电子将所有的金属离子维系在一起,形成晶体。
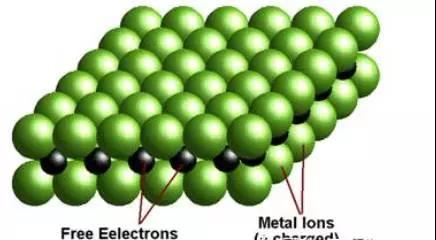
在以上内容的基础上,不难理解结构是如何决定性质的,如熔融金属的导电性,金刚石的高熔点,石墨的润滑作用等。
以上就是Bonding and structure知识点的介绍了,这里的知识点比较多而杂,同学们在学习这部分时要能够理解不同的结构如何决定物质的性质,以及这些物质的特点和作用等。想了解更多IGCSE化学的内容吗?那你就要关注唯寻国际教育官网了,从IGCSE化学到A2化学的内容应有尽有。如果您对我们的课程感兴趣,欢迎您点击【预约试听】了解更多。

赶紧点击
了解更多IGCSE化学信息。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
