
如果你问我IB化学有哪些重要的定律值得去背,我会毫不犹豫告诉你就是气体定律,它在定量化学中占据了非常大的分值。今天给大家讲解的是IB化学非常重要的考点-气体定律。一起来看看这些定律都有哪些公式吧!
其实千变万变都离不开理想气体状态方程PV=nRT,其中P指理想气体的压强,V为理想气体的体积,n表示气体物质的量,T表示理想气体热力学温度,为理想气体常数(8.314)。所以同学们需要牢记这个公式,遇到不同的条件时,只要进行公式变换就可以了。
根据Boyle定律,在一个固定的压强下,气体的压力和体积成反比。
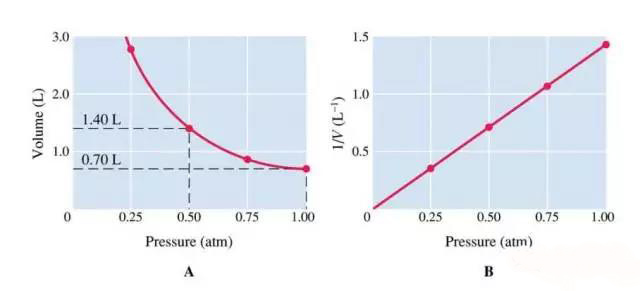
由于PV=constant,
理想气体状态方程PV=nRT,
那么P1V1=constant,
P2V2=constant,
则P1V1=P2V2。
例1:气球中氦气的压力在210KPa时,它的体积为4dm3,那么当气球的体积变为2.5dm3的时候它的压力会变为多少?
根据Boyle气体定律,P1V1=P2V2,(210KPa)(4dm3)=P2(2.5dm3),P2=340KPa
根据Charles气体定律,只要气体压力一定,气体的体积与开尔文温度(=oC+273.15)成正比。
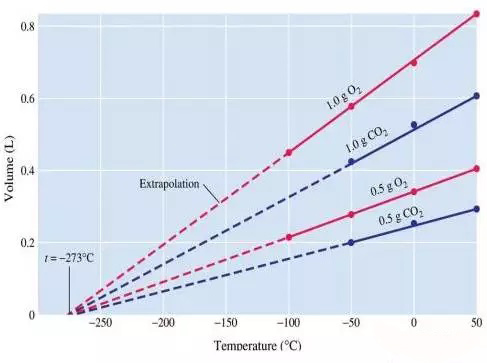
理想气体状态方程可以变形为:P=nRT/V,当气体压力一定时,nRT1/V1=nRT2/V2,n和R是不变的,则有: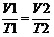
例2:一种气体在40摄氏度时占据了2.32dm3,当温度上升至75摄氏度时的气体最终体积?首先一定不要忘记摄氏度转换至开尔文温度,40oC=313K,75oC=348K,根据Charle定律,V1/T1=V2/T2,2.32dm3/313K=V2/348K,则V2=2.58dm3
Gay-Lussac定义了在体积一定时,压力和温度成正比的关系。
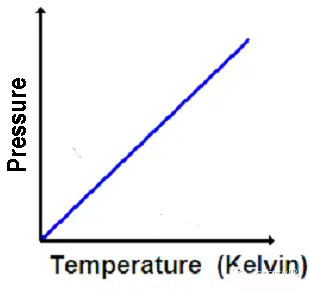
如果气体的物质的量一定,综上则有: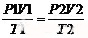
例3:在30摄氏度,110KPa下的气体充满在2dm3的容器里,温度上升至80摄氏度,压力上升至440KPa时,气体应该充满在多少体积的容器里?首先不要忘记开尔文温度的转换,30oC=303K, 80oC=353K,根据The Combined Gas Law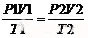 ,则
,则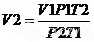 =0.58dm3
=0.58dm3
例4:在20摄氏度,大气压为0.880时,25g O2所占据的容器的体积是多少?据题意,气体的摩尔数n=m/M=25g/32g mol-1=0.781mol,温度转换为开尔文温度:T=20+273K=293K,R=0.08205 dm-3 atm mol-1K-1,根据理想气体状态方程PV=nRT,V=nRT/P=21.3 dm3
理想气体状态方程变形模式:气体密度d的计算: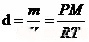 m为气体的质量,M为气体的摩尔质量;气体的摩尔质量M推导:M=dRT/P,,d为气体的密度(g/L)。
m为气体的质量,M为气体的摩尔质量;气体的摩尔质量M推导:M=dRT/P,,d为气体的密度(g/L)。
例5:在温度为27摄氏度,一个大气压下,2.10 dm3的容器里,有4.65g气体,那么这个气体的摩尔质量是多少?根据理想气体状态方程的变形模式:d=M/V = PM/RT, 其中d=m/V=4.65g/2.10dm3=2.21g/dm3
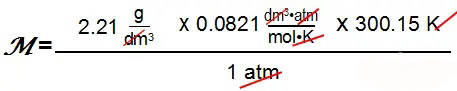
M=54.6g/mol
今天对IB化学定律介绍就到这里。不知道各位同学下次碰到这类题会不会更容易上手呢?如果你觉得以上技巧对你不太适用,点击预约试听【IB同步培训班】,小班课与1对1课均有开设,大大拉近导师与学员的对话距离。助教导师还将全程跟踪学员每天的课堂表现与课堂作业。

点击
查看更多。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
