
转眼已到winter vacation了,复习AP化学的同学们有没有发现在AP化学中有很多知识点都是紧密相连的呢?下面就给大家讲解一个重点的AP化学考试内容-库伦定律,同学们注意哦,这个定律可以用在很多知识点中,例如光电子能谱中的结合能,半径,电离能,晶格能,水合能等。
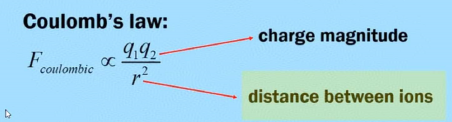
通过库伦定律,我们可以比较两个带电粒子间作用力的大小。通过公式可知带电粒子所带电量越大,带电粒子间距离越近,两个带电粒子间的作用力越大。例如:原子核带正电,核外电子带负电,两个带相反电性的粒子会相互吸引;原子核带电量越大,电子和原子核间距离越近,那么原子核对电子的吸引力越强。
如果我们很好的掌握了库伦定律,有关半径大小的理解就比较容易了。我们知道针对同一周期的主族元素,从左到右原子半径增加。AP化学考试,不但考结论,还倾向于考为什么,所以我们要会解释相应原因。
同一周期的主族元素,原子核外电子层数相同,但从左到右,原子核带电量在增加。依据库伦定律,由于原子核带电量增加,因此原子核对最外层电子的吸引力增加,那么最外层电子围绕着原子核更加紧密,原子半径减小。
很好的掌握库伦定律还可以帮助同学们比较电离能的大小。电离能是指从1mol气态原子相应的每个原子中移走一个电子所需要吸收的能量。例如(如图)Na 的电离能就是从1mol气态Na对应的每个Na原子中移走一个电子所需要吸收的能量。
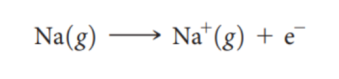
针对同一周期的主族元素从左到右,电离能依次增加。相应的原因同样是同一周期的主族元素,从左到右,原子核带电量在增加,因此原子核对最外层电子的吸引力增加,那么从原子中移走最外层一个电子所需能量会增加。
关于晶格能大小的比较我们同样用到库伦定律。晶格能是把1mol固体离子化合物变成气态离子所需要吸收的能量。考试中主要涉及离子化合物晶格能大小的比较。晶格能可以简单理解成把阴阳离子分开需要吸收的能量,所以阴阳离子吸引力越强,晶格能越大。
利用库仑定律,我们首先可以比较阴阳离子所带电荷,所带电荷越大,阴阳离子间吸引力越强,晶格能越大;如果对于不同物质,阴阳离子所带电荷相同,例如NaCl和KCl, 我们可以比较阴阳离子的半径,半径越小,阴阳离子间距离越近,吸引力越强,晶格能越大。

题目中比较LiCl和NaCl晶格能的大小。由于LiCl和NaCl所带电荷大小相同,我们可以比较离子半径,由于Li+半径小于Na+半径,阴阳离子间距离更近,吸引力更强,因此晶格能更大。经过上面的知识点分析可知,有时掌握一个原理,AP化学所涉及的一连串知识点的考题我们都能应对。所以在复习过程中同学们需注意知识点的总结。
给同学们准备的库伦定律知识点就到这里了,同学们在复习AP课程时要记得总结相关的知识点和考点,最好能够与真题结合,这样才能起到事倍功半的效果。
如今无论是是英国前10还是美国前20的学校,都非常认可及重视AP成绩。而且一般来说只有4-理想分的才能换到比较好的大学的学分,也就是说一旦参加考试,4分以上的分数才对申请有意义。如果这对你来说很难,甚至连自我感觉连保3都很有压力,点击预约试听【AP同步培训班】,紧贴考纲,精编唯寻核心讲义,AP将带你在AP灵活的考察体系里快速上分。

更多AP课程信息,您可以扫描下方二维码添加唯寻小助手了解更多。


学习有方法,成长看得见
筑梦牛剑/G5/常春藤
