
本期想来给大家讲讲Alevel化学氧化还原反应有关知识点,这部分的知识点涉及到电子转移、元素周期等。也是考试考查的重点。下面一起来看看这些知识点吧!
定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。
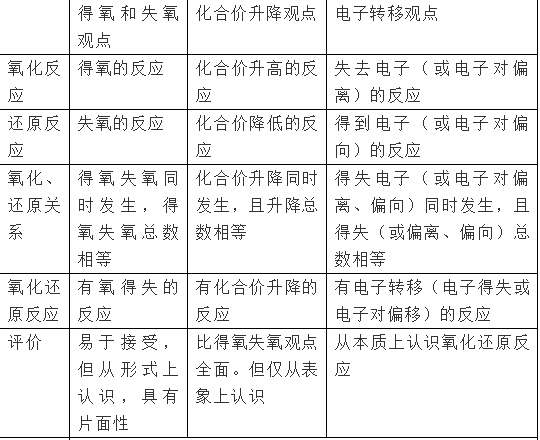
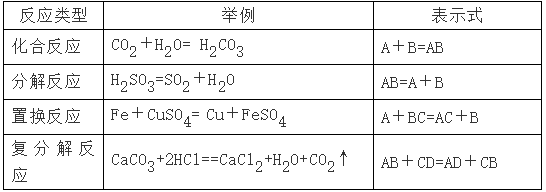
氧化还原反应与四种基本类型反应的关系
①置换反应全部属于氧化还原反应。
②复分解反应全部属于非氧化还原反应。
③有单质参加的化合反应全部是氧化还原反应。
④有单质生成的分解反应全部是氧化还原反应。
⑤有单质参与的化学反应不一定是氧化还原反应,如3O2=2O3。
氧化剂与还原剂
氧化剂:得到电子(或电子对偏向、化合价降低)的物质。
还原剂:失去电子(或电子对偏离、化合价升高)的物质。氧化剂具有氧化性,还原剂具有还原性。
氧化反应与还原反应
氧化反应:失去电子(化合价升高)的反应。
还原反应:得到电子(化合价降低)的反应。
氧化产物与还原产物
氧化产物:还原剂在反应中失去电子后被氧化形成的生成物。
还原产物:氧化剂在反应中得到电子后被还原形成的生成物。
氧化性与还原性
氧化剂具有的得电子的性质称为氧化性;
还原剂具有的失电子的性质称为还原性。
通过化学反应方程式比较:在一个化学反应中,氧化剂的氧化性>氧化产物,还原剂的还原性>还原产物。
依据金属活动性顺序:金属单质越活泼(还原性越强),对应阳离子的氧化性越弱。
依据元素周期律
金属单质的金属性越强,还原性越强,对应的金属阳离子的氧化性越弱;非金属单质的非金属性越强,氧化性越强,对应的阴离子的还原性越弱。
①对同一周期金属而言,从左到右,其金属活泼性依次减弱。如Na、Mg、A1金属性依次减弱,其还原性也依次减弱。
②对同主族的金属而言,从上到下,其金属活泼性依次增强。如Li、Na、K、Rb、Cs金属活泼性依次增强,其还原性也依次增强,对应的金属阳离子的氧化性减弱。
③对同主族的非金属而言,从上到下,其非金属活泼性依次减弱。如F、Cl、Br、I非金属活泼性依次减弱,其氧化性也依次减弱,对应的非金属阴离子的还原性增强。
依据反应条件:
是否加热、有无催化剂、反应温度、反应物的浓度。
MnO2+4HCl(浓) =(△) MnCl2+C12↑+2H2O
2KMnO4+16HCl(浓)=2MnCl2+5C12↑+8H2O(常温)
前者比后者容易发生反应 (不需要加热),可判断氧化性:KMnO4>MnO2。
依据相近似的反应:
氯气、硫与铜、铁的反应
如2Fe + Cl2=(△) FeCl3 , Fe + S=(△) FeS,根据铁被氧化程度的不同(Fe3+、Fe2+),可判断氧化性:C12>S。
如,2Cu + Cl2=(点燃) CuCl2,Cu + S=(△) CuS,即氧化性: Cl2>S。
同一种元素,一般价态越高其氧化性越强,但要注意特例。
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
一般来说,同种元素价越高,氧化性越强;价越低还原性越强。如氧化性:Fe3+>Fe2+>Fe,
S(+6价)>S(+4价)等,还原性:H2S>S>SO2,但是,氧化性:HClO4<HClO3<HClO2< HClO。
注意:①物质的氧化性、还原性不是一成不变的。同一物质在不同的条件下,其氧化能力或还原能力会有所不同。如:氧化性:HNO3(浓)>HNO3(稀);Cu与浓H2SO4常温下不反应,加热条件下反应;KMnO4在酸性条件下的氧化性比在中性、碱性条件下强。②原子的氧化性一般都强于分子的氧化性。如:氧化性F>F2、Cl>Cl2、O>O2等。
依据电化学原理。
①两种不同金属构成原电池的两极:负极:金属电子流出,正极:金属电子流入,还原性:负极>正极
②根据电解池中溶液里阴、阳离子在两极放电顺序(在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强)来判断。
如:Cl-失去电子的能力强于OH-,还原性: Cl->OH-。
常见氧化剂的相对强弱:
MnO4-(H+)>HClO>Cl2>浓硝酸>Br2>稀硝酸>Fe3+>I2
Fe3+>Cu2+>Fe2+
以上就是Alevel化学内容了,既然决定了要学习Alevel课程,就不要有投机取巧的心理,认真对待每一节课,每一次的考核,那么申请理想院校不是问题。
唯寻暑期先行班课帮你获取更多有关ALevel课程的学习方法与技巧,逐步攻克考试难关。点击【预约试听】即可报名
点击
查看。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
