
在今年的AP生物考试中,MC部分考到了蛋白质的结构,虽然之前给大家讲了一些Alevel生物蛋白质的一些知识点【Alevel生物蛋白质知识点以及计算题分享 赶紧接住这波拿A星的宝典吧】,但是由于课程体系的不同,考查的知识点也不一样哦,下面就来给大家讲讲AP生物蛋白质结构知识点。

组成元素
主要有C、H、O、N和S,有些蛋白质含有少量磷或金属元素铁、铜、锌、锰、钴、钼,个别蛋白质还含有碘 。
蛋白质元素组成的特点:各种蛋白质的含氮量很接近,平均为16%。
由于体内的含氮物质以蛋白质为主,因此,只要测定生物样品中的含氮量,就可以根据以下公式推算出蛋白质的大致含量:100克样品中蛋白质的含量 ( g % )= 每克样品含氮克数× 6.25×100
蛋白质的基本单位氨基酸
分类
1. 非极性氨基酸(9):甘氨酸 (Gly) 丙氨酸 ( Ala)缬氨酸(Val)亮氨酸(Leu)异亮氨酸(Ile)苯丙氨酸 (Phe)脯氨酸(Pro) 色氨酸(Try)蛋氨酸(Met)
2、 不带电荷极性氨基酸(6):丝氨酸(Ser) 酪氨酸(Try) 半胱氨酸 (Cys) 天冬酰胺 (Asn) 谷氨酰胺(Gln ) 苏氨酸(Thr )
3、 带负电荷氨基酸(酸性氨基酸)(2): 天冬氨酸(Asp ) 谷氨酸(Glu)
4、 带正电荷氨基酸(碱性氨基酸)(3):赖氨酸(Lys) 精氨酸(Arg) 组氨酸( His)
理化性质
两性解离及等电点
等电点 :在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。此时溶液的pH值称为该氨基酸的等电点。
紫外吸收
色氨酸、酪氨酸的最大吸收峰在 280 nm 附近。
大多数蛋白质含有这两种氨基酸残基,所以测定蛋白质溶液280nm的光吸收值是分析溶液中蛋白质含量的快速简便的方法。
肽
肽键是由一个氨基酸的a-羧基与另一个氨基酸的a-氨基脱水缩合而形成的化学键。
肽是由氨基酸通过肽键缩合而形成的化合物。
由十个以内氨基酸相连而成的肽称为寡肽,由更多的氨基酸相连形成的肽称多肽
肽链中的氨基酸分子因为脱水缩合而基团不全,被称为氨基酸残基
多肽链是指许多氨基酸之间以肽键连接而成的一种结构。
多肽链有两端 :N 末端:多肽链中有自由氨基的一端
C 末端:多肽链中有自由羧基的一端
生物活性肽
谷胱甘肽
多肽类激素及神经肽

蛋白质的一级结构
1、定义:蛋白质的一级结构指多肽链中氨基酸的连接方式、排列顺序和二硫键的位置。
2、主要的化学键:肽键,有些蛋白质还包括二硫键。
3、一级结构是蛋白质空间构象和特异生物学功能的基础。
蛋白质的二级结构
1、定义:蛋白质分子中某一段肽链的局部空间结构,即该段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象
2、主要的化学键: 氢键
3、蛋白质二级结构的主要形式a-螺旋、 b-折叠、b-转角、无规卷曲
蛋白质的三级结构
1、 定义:整条肽链中全部氨基酸残基的相对空间位置。即肽链中所有原子在三维空间的排布位置。
2、主要的化学键 :疏水作用、离子键、氢键和 Van der Waals力等
蛋白质的四级结构
1、蛋白质分子中各亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质的四级结构。
2、亚基之间的结合力主要是疏水作用,其次是氢键和离子键。
蛋白质的理化性质
蛋白质的紫外吸收
蛋白质的两性电离
蛋白质的等电点: 当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零,此时溶液的pH称为蛋白质的等电点。
蛋白质的沉降特性
蛋白质的胶体性质
蛋白质胶体稳定的因素:颗粒表面电荷、水化膜
蛋白质的变性、复性
1、蛋白质的变性:在某些物理和化学因素作用下,其特定的空间构象被破坏,也即有序的空间结构变成无序的空间结构,从而导致其理化性质改变和生物活性的丧失。
2、变性的本质 :破坏非共价键和二硫键,不改变蛋白质的一级结构。
蛋白质的呈色反应
茚三酮反应 蛋白质经水解后产生的氨基酸也可发生茚三酮反应。
双缩脲反应
蛋白质和多肽分子中肽键在稀碱溶液中与硫酸铜共热,呈现紫色或红色,此反应称为双缩脲反应,双缩脲反应可用来检测蛋白质水解程度。
以上就是给大家准备的一些有关AP生物蛋白质结构的知识点,在今年的A2中MC就考察了蛋白质结构部分,所以同学们对于这些知识点还是需要好好准备一下的, summer vacation马上就要来了,同学们赶紧来参加唯寻的AP暑期先修班吧,导师能够根据你的学习进度为你制定出合适的学习计划哦!
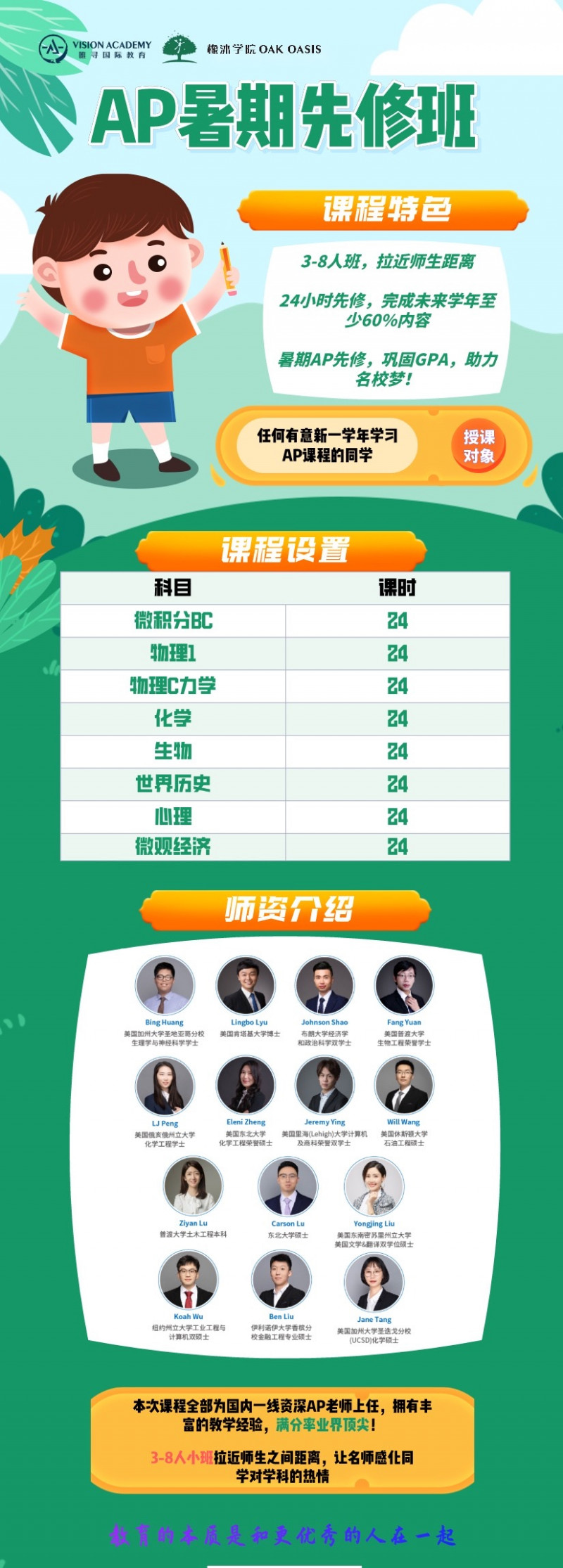
点击
这些历年考到的AP生物考试知识点总结来了 别不信有每年的AP生物真题作证哦
查看。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
