
本文将为大家介绍IB化学考试的形式,同时将重点介绍下计算题的六大核心技巧和知识点。包括配平方法、摩尔质量、实验式、质量、体积计算等等。可以说,你关于IB化学考试计算的一切疑问都可以在这篇得到解答。

IB化学(HL)试卷考试分为3个部分。
•Paper1考试时长60分钟,考试内容为40到选择题,占总分比例为20%;
•Paper2考试时长为135分钟,考试内容的A部分为必答题,B部分选2道问题回答,分数占总分比例为36%;
•Paper3考试时长为75分钟,总共有7道题目,从中选2道做答,占总分比例为20%。
IB化学(SL)试卷考试也是分3个部分。
•Paper1考试时长45分钟,考试内容为30道选择题,占总分比例为20%;
•Paper2考试时长为75分钟,考试内容的A部分为必答题,B部分选2道问题作答,分数占总分比例为32%;
•Paper3考试时长为60分钟,总共有7道题目,从中选2道做答,占总分比例为24%。
1. Balance chemical equation (配平化学方程式)
配平化学方程式是IB化学章的第一个实际内容。在教材中所占篇幅虽然不多,但在以后的章节学习和考试中会有大量应用。正确的化学方程式是计算的前提,而书写正确的化学方程式的关键是配平,因此具有快速、正确配平化学方程式的能力对于IB化学的成绩进阶有显著的帮助。
幸运的是,所有的化学方程式都可以用所谓的“待定系数法”来配平,即先设出化学方程式中某些物质的化学计量数(coefficient),然后根据原子守恒可求出未知数的值,最后根据题目要求标注物质状态(state symbol)。
Example
对于一个未配平的化学方程式:C2H7N + O2 → CO2 + H2O + N2
Step1. 先设C2H7N的系数为x,O2系数为y
Step2. 则根据原子守恒有:xC2H7N + yO2 → 2xCO2 + 3.5xH2O + 0.5xN2
Step3. 由此可以得到:y = 3.75x,最简整数比为x : y = 4 : 15
Step4. 因此完整的化学方程式为4C2H7N + 15O2 → 8CO2 + 14H2O + 2N2
Step5. 最后标注物质状态4C2H7N (g) + 15O2 (g) → 8CO2 (g) + 14H2O (l) + 2N2 (g)
该方法的核心原则是原子守恒,基础是数学计算。只要搞清原子的去向,算对系数的关系,这一类的题目就不会出错,的问题就是完成的快慢,而这就需要大量的练习了。
2. Mole concept (摩尔的概念)
Mole是一个在化学中非常简单但又非常重要的概念,它指的是化学中表示物质的量的单位,简写为mol。 1mol的任何物质含有约6.02x1023个组成该物质的粒子,即6.02x1023 mol-1,该数被称为阿伏伽德罗常数(Avogadro constant),通常用L或NA表示。
摩尔质量(Molar mass)是指1mol某种物质的质量,通常用M表示,其数值与该物质的相对分子质量或相对原子质量相等,单位是g/mol。摩尔质量是每一种物质都具有的物理性质。摩尔数(n)、粒子数(N)和质量(m)之间的换算关系如下:
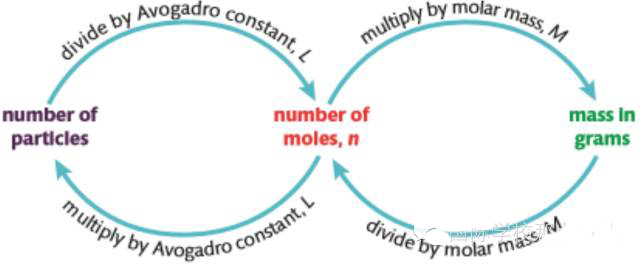
这一部分内容是学习化学计量学最重要的基础,其核心是对相关概念的理解以及这些概念之间的换算关系,知识点本身没有什么难度,需要注意的就是上图中相互换算的乘除算法不要记反了,通过记住各个概念的单位,并了解这些单位之间的关系有助于解决这个问题。
3. Determine empirical formula (确定实验式)
实验式(empirical formula)又称最简式或经验式,是化学式中的一种。用元素符号表示化合物分子中各元素的原子个数比的最简关系式。物质的实验式与其分子式不一定相同,但分子式中各个原子的系数一定是实验式的整数倍。由于实验式一般都是通过分析化学的元素分析法(elemental analysis)获得的,尤其是通过有机化学中燃烧法测定化合物中碳氢比,因此称为实验式。
Example
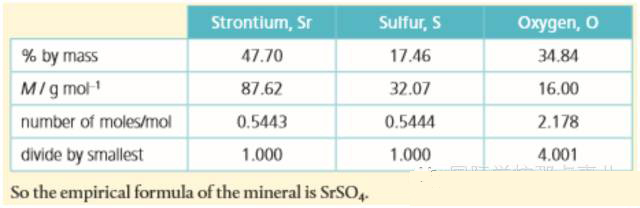
一般确定实验式的题目都是通过质量分析,即通过实验给出组成分子的各元素的质量或质量百分比,在此基础上求实验式。
Step1. 由给定的元素质量计算该元素的摩尔数。即已知m求n:n=m/M
Step2. 计算出所有元素的摩尔数,然后将它们之间的数量关系化为比例关系(ratio by mole)。
Step3. 将上述所得的比例约化为最简整数比,即为实验式中各原子的数量比。
确定实验式的题目一般是中等难度,解题过程并不复杂,计算也可以用计算器。需要注意的是在一些比较困难的题目中,求最简整数比的数学过程并不是十分容易的。
4. Calculate reacting mass and volume (计算反应中的质量和体积)
化学方程式中根据参与反应的一种物质的质量可以换算出其他物质的质量。这类题目多是问答题,但难度不高。
Example
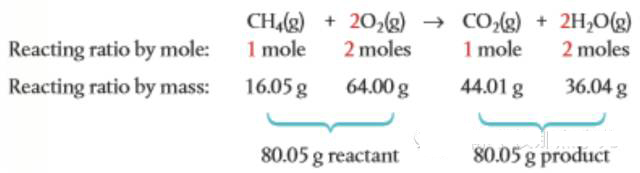
Step1. Mole ratio: 参与反应的各个物质的摩尔比即是它们在方程式中各自的系数比。
Step2. Mass ratio: 由各个物质的摩尔比计算它们的质量比,即由n求m:m=nM
Step3. 由题目给定的某种物质的质量结合上面求得的质量比计算目标物质的质量。
5. Limiting reactant (限量试剂)
在一些通过化学方程式计算生成物产量的题目中,会给出多个反应物的质量,但它们的质量并不一定恰好满足方程式中的系数比。此时学员需要通过计算它们的摩尔数来判断哪个是限量试剂(limiting reactant),并以它做为有效数据来计算生成物产量(yield)或者产率(percentage yield)。这一类题目通常较难。
Example

Step1. Calculate number of mole: 由给出的反应物质量计算它们的摩尔数。
Step2. Calculate ratio given: 计算题目所给定的反应物的摩尔比。
Step3. 比较题目给定的摩尔比与方程式中的摩尔比,相对最小的即为limiting reactant
Step4. 以limiting reactant计算生成物产量。
6. Gas law (气体定律)
理想气体(ideal gas):分子间无相互作用力,分子大小可以忽略的气体,现实中不存在严格的理想气体,只有近似理想状态的气体。
理想气体方程(ideal gas law):PV=nRT
P: Pressure,气体压强;
V: volume,气体体积;
T: temperature,温度(单位为K)
R: universal gas constant,8.31J.mol-1.K-1
Standard temperature and pressure (STP): 273K, 100KPa. 标准状态
根据理想气体方程,STP条件下1mol任何气体的体积都是22.7L.
气体定律这部分的内容主要是公式、概念和一些常数的理解和记忆。出的题目主要是计算题和解释题,解题思路基本都是往理想气体和气体方程上靠。题目难度一般不高,但有时会与反应计算的内容结合出题,难度进阶。
有关IB化学考试和计算题答题攻略介绍就到这里。 每个选了IB化学的同学,都要以7分为位最高目标。尤其是对于要用IB成绩申请英国大学的同学来说,2020英本申请人数已经破了76万,中国学员申请人数更是2016年的两倍。

这意味想拿到,就需要比往年更有竞争力的分数。如果你的IB考试始终发挥不稳定,点击报名【IB同步培训班】——
汇聚全球知名大学海归IB导师
线上线下同步授课
28门国际课程已完全覆盖SL/HL两大级别
TOK IA EE套餐类课程灵活有效
带你提前更有班主任学术督导

唯寻学员的IB平均分高达40.19,远超亚太地区及全球IB平均分。


更多IB学习攻略点击
【文末福利】
扫码添加小唯,
转发本文至朋友圈,
集齐10个赞,
她就会给你发50篇TOK SAMPLE大礼包

↑小唯 你的专属留学顾问↑

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
