
对于IB的同学们来说,不管IB大考是否能够正常举行,此刻重要的事情是复习,因为只有复习好,才能胸有成竹的应对接下来的考试。下面给大家讲讲IB化学Covalent bonding知识点,有需要的同学可以一起来回顾这部分的知识点。
Covalent bonding---电负性相差较小或者相同的原子以共享电子对的形式而形成,用于共享的电子对叫做成键电子对(shared pairs、bonding pairs),未参与共享的电子对叫做孤对电子(lone pairs、unshared pairs)。
首先我们来了解一下VSEPR----Valence shell Electron pair Repulsion,阶层电子对互斥理论。阶层电子对既有成键电子对,又有孤对电子,我们知道电子带负电荷,所以电子对之间存在排斥的现象。
孤对电子与孤对电子之间的排斥 (排斥最强)
孤对电子和成键电子对之间的排斥
成键电子对之间的排斥(排斥最弱)
所以往往在考题中,需优化考虑分子中的中心原子其孤对电子对的数量
下面给大家带来几个例子
常见不含孤对电子的分子
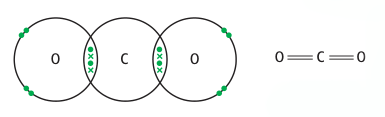
CO2 ,其电子结构为 C=O=C,中心原子为C,不存在孤对电子,所以其空间结构为直线型(linear),键角成180度
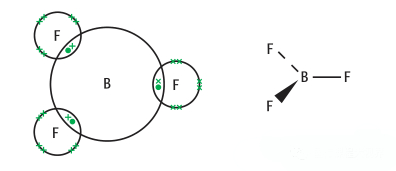
BF3,中心原子为B,不存在孤对电子,存在三个B-F键,键角(B-F键和B-F键之间的角度)为120度,成平面三角结构(Trigonal Planar)
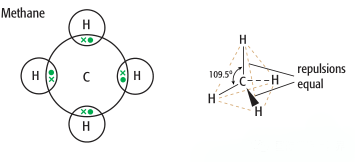
CH4,中心原子为C,不存在孤对电子,存在4个C-H键,键角为109.5度,结构为正四面体(Tetrahedral)
常见含有一对孤对电子的分子
SO2,其中心原子S上有一对孤对电子,孤对电子会排斥成键电子对,使其结构成为V-sharp(V字型)
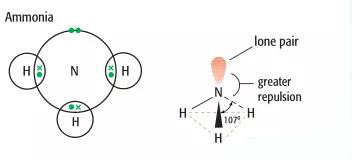
NH3,其中心原子N上有一对孤对电子,键角为107度,所以其结构并不是平面三角,而是三角锥结构,同样是因为孤对电子对三个N-H键的排斥。
常见含有两对对孤对电子的分子
H2O,中心原子O上存在两对孤对电子,其结构任为V字型,键角为104.5度。注意它的键角(O-H和O-H之间的角)比上述只有一对孤对电子的更小,原因还是因为孤对电子对的排斥较强。

最后有几个特列需要注意一下
SF6,其分子中有6个S-F键,没有孤对电子,键角为90度,结构为Octahedral
PF5,其分子中有5个P-F键,没有孤对电子,结构为Trigonal Bipyramidal
以上就是我们今天对IB化学的解析及答题技巧介绍。希望能加速你的保6冲7之路。如果你发现之前在哪个章节落下了学习进度,很难补齐,点击预约试听【IB同步培训班】,一线海归IB授课,根据每位学员的情况与能力定制同步辅导课程,助教导师全程跟进记录,助力最佳学习效果,让每个学员都能有快速高效看得见的成绩进步。
点击
查看。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
