
AP化学电离能也是一个重要的考点,在理解这部分时最好能够记住电离能规律图像以及应用。下面就来给大家一起来看看本期准备的AP化学电离能的知识点吧!
电离能
电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,符号:I1,单位:kJ/mol。
电离能(I1):气态电中性基态原子失去1个电子转化为+1价气态阳离子所需要的最低能量叫电离能。
第二电离能(I2):气态+1价阳离子再失去1个电子形成+1价气态阳离子所需要的能量。
规律
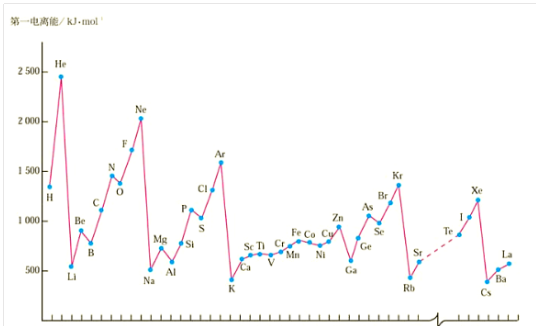
a.同周期:种元素的电离能最小,最后一种元素的电离能最大,总体呈现从左至右逐渐增大的变化趋势。
b.同族元素:从上至下电离能逐渐减小。
c.同种原子:逐级电离能越来越大(即I1<I2<I3…)。
电离能、电负性的应用
①判断元素金属性的强弱
电离能越小,金属越容易失去电子,金属性越强;反之越弱。
②判断元素的化合价(I1、I2……表示各级电离能)
如果某元素的In+1≫In,则该元素的常见化合价为+n。如钠元素I2≫I1,所以钠元素的化合价为+1。
③判断核外电子的分层排布情况
多电子原子中,元素的各级电离能逐级增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
④反映元素原子的核外电子排布特点
同周期元素从左向右,元素的电离能并不是逐渐增大的,当元素的核外电子排布是全空、半充满和全充满状态时,电离能就会反常的大。

题目中陈述的就是我们讲的电离能的概念,从气态原子移走一个电子所需要的能量。所以很容易选出答案A选项。
中国考生的AP化学成绩分布一贯呈倒三角形,这说明选化学这门课的优势是非常大的,只要踏实复习,保4冲5是没问题的。如果你觉得复习时间来不及,可以点击预约试听【唯寻AP暑期先修班】——
点击
查看。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
