
IGCSE化学知识点繁多,氧化还原就是其中的重点之一,也会贯穿到ALEVEL阶段的学习。那本文就来整理一下与之相关的概念,临考试前可以用来复习,新课学习前也能够拿来预习。
IGCSE 阶段的化学包括基础化学理论,认识常见化学物质以及学习简单的化学反应。内容涉及到物质状态,基本实验方法,原子理论简介,方程式的书写、配平及计算,化学反应速率及能量变化,基本反应类型(氧化还原反应、酸碱反应、金属及非金属),有机化学等等。
IGCSE化学会考3张paper,学习核心大纲的学员考paper1、paper2及paper5/paper6。学习拓展大纲的学员考paper2、paper4及paper5/paper6。
3张paper分别为选择题卷(40道选择题)、理论题卷(简答题及结构化问题)及实验题卷。选择题卷占总成绩的30%,理论题与实验题分别占总成绩的50%及20%。
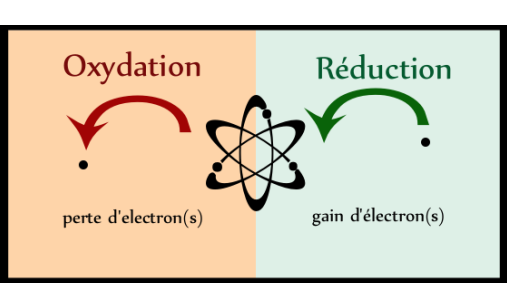
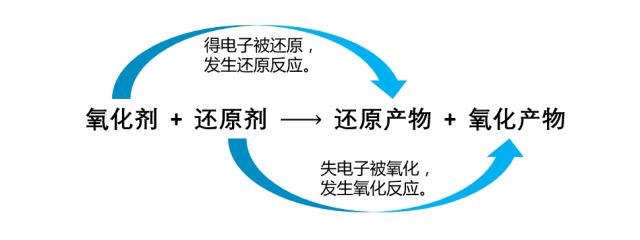
氧化还原是化学中一个十分重要的概念,许许多多反应都是氧化还原反应。这个概念由最早的得氧和失氧,发展为化合价的升高和降低,以致到现在的电子得失观点,失电子为氧化,得电子为还原,概念的提出由现象到本质,逐步深入。
1.氧化还原反应的本质:有电子转移(得失)
氧化还原反应概念图
2.氧化还原反应的特征:元素化合价的变化
升失氧氧还原剂,降得还还氧化剂(化合价上升,失电子,发生氧化反应,被氧化得到氧化产物,在反应中做还原剂;化合价下降,得电子,发生还原反应,被还原得到还原产物,在反应中做氧化剂)。
3.化学反应的分类
我们把化学反应按是否发生电子转移分成两大类:氧化还原反应和非氧化还原反应。下面我们来介绍氧化还原反应与四种基本反应类型的关系:
①置换反应置换反应是单质与化合物反应生成新单质和新化合物,该过程一定伴随着电子得失,故一定是氧化还原反应。如我们熟悉的Fe + CuSO4 == FeSO4 + Cu,
铁失2个电子生成亚铁离子,同时,铜离子得两个电子生成铜单质。
②复分解反应
与置换反应性质完全相反地,复分解反应是两种化合物互相交换成分,并不存在电子转移,故一定不是氧化还原反应。如HCl + NaOH == NaCl + H2O.
③化合反应和分解反应
而化合反应和分解反应既可能是氧化还原反应,如:C + O2 =点燃= CO2;2H2O2 =(MnO2)= 2H2O + O2↑;又可能是非氧化还原反应,如:CaO + H2O == Ca(OH)2 ;2NaHCO3 =△= Na2CO3 + H2O + CO2↑.
4.特殊情况
i. 在氧化还原反应中,氧化剂和还原剂可能是同一种物质,氧化产物和还原产物也可能是同一种物质,如歧化反应和部分归中反应。
歧化反应:在反应中,若氧化作用和还原作用发生在同一分子内部处于同一氧化态的元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原,那么我们称这种自身的氧化还原反应为歧化反应。
如氯气和氢氧化钠的反应(氯既做氧化剂又做还原剂):Cl2 + 2NaOH = NaCl + NaClO + H2O归中反应:在反应中,同种元素组成的不同物质中元素的两种化合价向中间靠拢,那么我们称这种氧化还原反应为归中反应。
部分归中反应可以使同种元素的不同化合价达到相同价态,如铁和氯化铁溶液的反应:Fe + 2FeCl3 == 3FeCl2也有部分归中反应会使同种元素的化合价彼此接近但不能达到相同价态,但是不存在价态交叉现
氧化还原反应相关IGCSE化学知识点就整理到这里。每年都有很多基础很好的考生在GCSE化学考试中失败,也有很多基础一般但是勤奋学习的考生拿到A*。
这说明想学好化学,很多时候拼的不是天赋,而是学习方法和技巧。如果你觉得光靠自己分类找题、摸索方法有点慢,可以点击预约试听【IGCSE同步培训班】——
开设GCSE15+科目辅导
内容适应多个考试局
国际课程辅导团队+助教+个人顾问
帮助学员稳稳过渡国际课程适应期,
知识积累、考试技巧、习惯养成,习题训练逐一击破,


不要小看GCSE这段“适应期”,这个成绩可是分隔普通学员与大神的一道分水岭,也是牛校发录取通知时重要的参考因素。
除了IGCSE化学知识点,你还可以看↓

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
