
同学们应该都知道化学中有大量的计算题,本期给大家介绍的这个知识点也是离不开公式、计算的。下面就一起来看看本期AP化学考点吉布斯自由能的计算吧!
吉布斯自由能这是这么一个可以判断在封闭系统中是否发生了自发过程的状态函数。它的大小相当于系统向环境做最大可能的有用功:
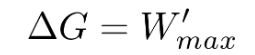
对于化学反应,吉布斯自由能的变化量可以用电化学的方法来测得:
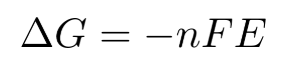
其中E为电动势,F为法拉第常数96500C/mol。
当计算一个反应的吉布斯自由能时,我们不会直接得到这个反应的焓变,熵变,而是得到其他辅助条件,帮助我们间接计算出反应吉布斯自由能变化。此时我们需要建立一个这样的三角,此时反应的吉布斯自由能变化就是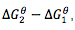
由于此时最下面的都是单质,剪头的尾端则是化合物,所以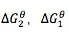 就是两边的化合物的吉布斯生成自由能。这里需要注意的是化学计量数,因为生成自由能是以1mol为单位的,所以在计算能量时要乘以化学计量数。
就是两边的化合物的吉布斯生成自由能。这里需要注意的是化学计量数,因为生成自由能是以1mol为单位的,所以在计算能量时要乘以化学计量数。
同学们注意:
吉布斯自由能改变量-ΔG=-(G2-G1)>=W非。表明状态函数G是体系所具有的在等温等压下做非体积功的能力。反应过程中G的减少量-ΔG是体系做非体积功的最大限度。这个最大限度在可逆途径得到实现。反应进行的方向和方式可以由ΔG进行判断:
-ΔG>W非 反应以不可逆方式自发进行
-ΔG=W非 反应以可逆方式进行
-ΔG<W非 不能进行
若反应在等温等压下进行,不做非体积功,即W非=0则
ΔG<0 自发进行
ΔG=0 不能进行
ΔG>0 逆反应自发进行
可见等温等压下体系的吉布斯自由能减小的方向是不做非体积功的化学反应进行的方向。任何等温等压下不做非体积功的自发过程的吉布斯自由能都将减少。
在温度T时,当反应物和生成物都处于标准态,发生反应进度
标准自由能推理过程
为1 mol的化学反应Gibbs自由能的变化值,称为标准摩尔反应,吉布斯自由能变化值,用来表示标准吉布斯自由能与一般反应的吉布斯自由能的关系:هه
等温、等压的封闭体系内,不作非体积功的前提下,任何自发反应总是朝着吉布斯自由能(G)减小的方向进行。ΔG=0时,反应达平衡,体系的G降到最小值。
对于大部分同学来说,AP化学考试的答题节奏还是非常紧张的。如果这个问题也困扰着你,可以点击预约试听【AP化学复习冲刺班】,相信只要肯学都是路——
唯寻AP天团+助教+个人顾问多对一教学 ,

点击
查看。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
