
很多IB的都会觉得化学太难,因为IB化学有大量的概念,反应需要同学们来记忆,如何将这些概念规则反应记下来呢?这时候就需要一些技巧了。选修IB化学的同学们赶紧把下面这些关于酸碱盐溶解度规则和口诀记下来吧!
IB化学酸碱中和反应
1.概念:酸碱中和反应是酸和碱的作用而生成的盐和水的化学反应。最常见的例子来说就是,HCl与NaOH反应,生成NaCl和H2O。
2.反应原理:酸/碱溶液溶解在水中,被电离成阳离子阴离子。酸性溶液中的H+和碱性溶液中的OH-结合,就生成了一个中性的水H2O。如HCl电离成氢离子(H)和氯离子(Cl-),NaOH电离成钠离子(Na)和氢氧化物离子(OH-),溶液中剩余的钠和氯离子仍在溶液中电离而不结合,但产物是NaCl。
3.现象:中和反应是放热的,反应过程会出现很明显的化学现象,生成这样的盐沉淀物。但是,某些酸碱中和学员反应中不会有太明显的现象,我们就需要在反应前滴入指示剂帮助需要我们可以观察能是否有发生。
4.应用:医药、农业和工业使用酸碱中和反应是非常广泛的。比如,改变受到我国酸雨产生影响的土壤的酸碱性;处理企业工厂的废水,碱性环境污水需用酸来中和,酸性污水需用碱来中和;用含氢氧化铝的药片可以治疗患者胃酸过多;被蚊虫叮咬后涂含有一个碱性化学物质的药水……
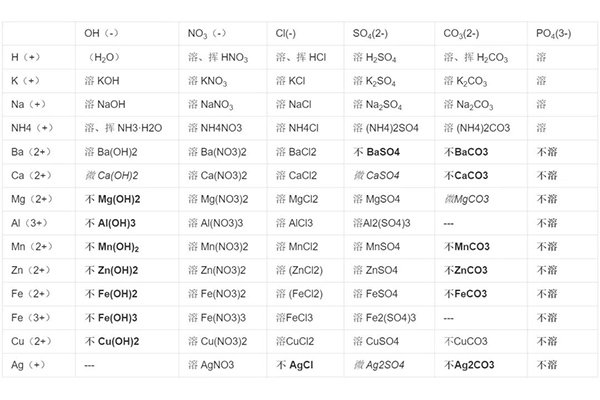
IB化学酸碱盐溶解度规则
IB化学溶液是怎样产生的呢?
首先,我们要分清solute和solvent分别是什么。Solute叫溶质,是需要被溶解的。这里的溶质可以是固体,液体或气体。而Solvent是用来溶解solute的,故而叫溶剂。溶剂不可以是固体,只能是液体或气体。
一般来说,溶质和溶剂混合后的溶液(solution)会有三种情况:
1. 如果溶液里的溶质比较少,少于溶剂最大的可溶解量(its solubility),那么这个溶液就是稀溶液(dilute solution)
2. 如果溶质的量与其溶解度完全相同,则它已饱和。It is saturated.
3. 如果溶质是过量的,它超过了溶剂的溶解力,则多余的溶质将从溶液中分离出来。如果该分离过程包括结晶(crystallization),我们则可以观察到形成的沉淀(precipitation)。经过沉淀,溶质的浓度降低至饱和,以进阶溶液的稳定性。
以上就是IB化学酸碱盐溶解度的一些信息了,关于酸碱盐溶解度的规则网上有很多口诀,同学们可以根据自己的记忆特点记下来,但是IB化学还是要靠同学们自己的理解记忆,毕竟还涉及到很多实验。如果您对IB学习感到力不从心,那就来唯寻吧!

了解更多IB课程培训的话,点击【惊喜福利IB化学培训课程开班了 带你理清IB化学课程】、【IB化学真题精析化 paper 3轻易拿满分】查看详细的信息。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
