
化学虽然是同学们在早期一直都在学的科目,但是对于一些刚接触IGCSE课程的同学来说仍然是有一定的难度,因为除了专业词汇以外,很对学员对于一些概念仍然是理不清。为了解决大家学IGCSE化学的痛点,本期给大家讲一下IGCSE化学物质的量,教你掌握质量守恒法则。【如何复习IGCSE化学 看过来人怎么说】
物质的量的概念:
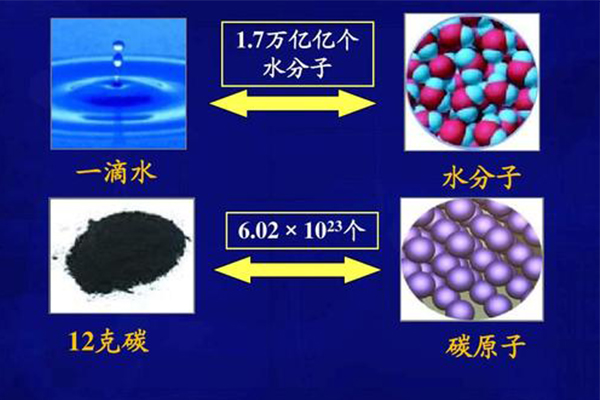
物质的量概念就是跟物质的“数量”有关,单位是摩尔,写为mol。科学定义上:One mole is the amount of matter that contains as many particles (atoms, ions or molecules) as the number of atoms in exactly 12g of carbon-12.
摩尔是物质总共含有的颗粒数与12g 碳-12含有的原子数相同。
虽然这个定义也只提到数量跟C-12所具有的原子数有关,没有给出具体的数值。但是,科学家很早以前就已经测得了这个数值,并给它起了名。From experiments, scientists have determined this number to be 6.0221421*10²³, which we will usually round to 6.02*10²³. Scientists call this value Avogadro’s constant (阿伏伽德罗常数), NA, in honor of the Italian scientist Amedeo Avogadro (1776-1856). 至此,我们知道1mol = 6.02*10²³个颗粒数,或者1mol=1NA,即1mol为1个阿伏伽德罗常数。

n: 物质的量
NA: 阿伏伽德罗常数
N:颗粒数量
上述公式就将mole与颗粒数量结合了起来。
但是我们在实验室中对物质的取用不可能说取2个H2O来进行反应,还是得回到质量上,运用称量器来称取一定质量的物品进行化学反应。让我们再次回到先前的买水果这个例子上。从简单的生活经验上我们也可以发现,质量跟数量是有一定关系的,数量越多,相应的质量也越大。那么在原子级别的颗粒上也是如此。科学家们也用一个新的概念来连接质量与物质的量。
The mass in grams of one mole of a substance (that is, the mass in grams per mole) is called the molar mass (摩尔质量) of the substance. 1摩尔物质的质量被称为该物质的摩尔质量 (g/mol)。我们知道1mol就是12g C-12中所含有的原子数。The molar mass (symbol M) is just the numerical value (数值大小)of the relative atomic mass (相对原子质量),即摩尔质量(符号M)的数值大小与相对原子质量一致。

n: 物质的量
m:质量
M:相对原子质量
至此,我们已经能够将质量跟颗粒数量建立起了关系。下面我们将结合例题进行分析。
How many nitric acid molecules are in 4.20g of HNO3?
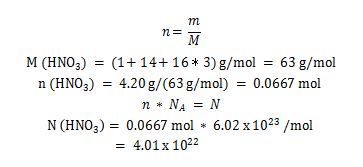
看了以上的例题,同学们有没有清楚什么是物质的量呢?明白了颗粒数量和相对原子质量之间的关系呢?同学们在做这种类型的题目时一定要熟记公式,通过公式来解答后续问题。【IGCSE化学反应大全 这样学不要背单词一样能够拿A】今天IG化学知识点到这里就结束了,如果有后续知识点疑问或者辅导课程需求,欢迎您点击【预约报名】,唯寻现在推出了igcse课程班,带你一网打尽重难点。

唯寻现集结了超180名全职海归,其中35名本科毕业于牛津或剑桥大学,让全世界的中国学员在线参与国际课程学习,开设数学、高等数学、物理、化学、生物、经济等超28门国际课程,辅导了来自700多所国际学校的超5000名学员,90%学员成绩提升一个等级以上。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
