
今天给大家讲解IB化学电离能这方面的知识点,这一方面希望同学们都能够明白,复习的更彻底。
Electrons(电子)和Protons(质子)之间存在正负电荷间的静电吸引力,我们叫做electrostatic attraction,那么如需要从原子中移除一个电子,需要提供一定的能量来克服静电吸引力,我们这一能量叫做电子能。
The 1st Ionization energy(电离能):The energy needed to remove one electron from each atom in one mole of atoms of the element in the gaseous state to form one mole of gaseous 1+ ions
注意这里为气体状态下,1mol原子每个失去一个电子所需要的能量,其单位KJ/mol
我们在判断电离能在元素周期表的趋势前,首先来了解一下原子半径(Atomic radius)的趋势,在元素周期表中,同一个period中(同一行),从左往右,原子半径逐渐减小,原因为同一周期其电子层数相同,Shielding effect(屏蔽作用:内层电子对最外层电子的排斥)相近,但是核电荷数从左往右是逐渐增加的,所以对外层电子的吸引力也是逐渐增加,那么原子半径是也是逐渐减小。
同一个Group中,从上往下,电子层数逐渐增加,所以原子半径逐渐扩大。
那么我们来判断一下电子能的趋势
同一周期(同行):从左往右,原子核对最外层电子的吸引力增加,原子半径减小,移除一个电子的能量增加,所以电离能是逐渐增加的。、
特别注意(重要考点):Mg和Al,Mg的电离能大于Al的,因为Mg的最外层电子结构为3s2,而Al为3s2 3p1,也就是说Mg在3s这一亚层是满的(更稳定),而Al在3p1并不是,类似的考点还有氧(O)和氮(N)之间也存在。
同一族(同列):从上往下,原子半价增加,原子核对最外层电子的吸引力减弱,所以电离能是逐渐减小的。
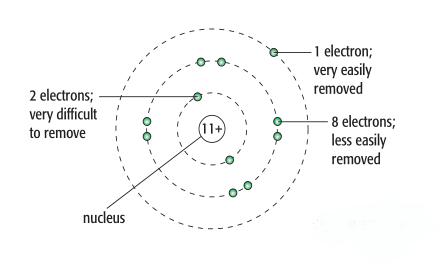
除此之外,还有第二电子能(第三、第四等),从电离能依次往下是逐渐增加的,其之间的间隔却是不同的,我们判断的依据还是电子排布结构,如Na其电子结构为1s2 2s2 2p6 3s1,其电离能和第二电离能之间差距特别大,因为电离能在3s1上,而第二在2p6上,同理其第二电离能和第三电离能之间差距就说相对小很多,因为其都在2p上。
以上就是IB化学知识点的讲解了,IB化学想得高分还是有一定的难度,为了帮助大家更好的应对IB化学,唯寻特地开设了IB课程班,来自世界优质院校的们,带您一起走进奇妙的化学世界。点击【预约试听】即可报名。
点击
查看。

学习有方法,成长看得见
筑梦牛剑/G5/常春藤
